
引言
蛋白质是生理功能的执行者,是生命现象的直接体现者。对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。因此,对蛋白质的研究需要更加系统和精准。而蛋白微阵列(Microarray),指将一物种的所有蛋白质固定在固相载体上而集成的微阵列,我们也称为蛋白芯片,因为其高通量、高灵敏度的特点,成为全局性、系统性的开展蛋白质相关研究的有力工具。
一、高通量蛋白筛选利器
HuProt™人类蛋白质组芯片,是迄今为止通量最高的人类蛋白质组芯片。它包含超过21000种人类蛋白质和蛋白质亚型,覆盖了人类蛋白质图谱定义的81%标准表达蛋白质,这些蛋白广泛覆盖受体、转录因子、激酶、胞外基质蛋白、细胞骨架蛋白等30余种蛋白类型,可用于多种生物学功能的创新研究。


图2 HuProt™人类蛋白质组芯片中21000个蛋白的功能分布
作为蛋白质组学工具,HuProt™人类蛋白质组芯片已应用于多个研究领域,如药物作用靶标发现及药物作用机理研究、血清标志物和新免疫原的发现、蛋白质-蛋白质相互作用研究、蛋白质翻译后修饰研究、非编码RNA作用机制研究、蛋白质与DNA相互作用研究、抗体特异性筛选、酶底物研究等,从全局揭示人类疾病尤其是肿瘤性疾病的发生、发展以及用药后的作用机理。

图3 不同应用场景下HuProt™人类蛋白质组芯片的反应原理
全文将围绕上述图中HuProt™人类蛋白质组芯片的六大应用场景进行逐一介绍,而本期将首先从其在肿瘤标志物的研究应用展开。
二、助力肿瘤标志物研究
肝细胞癌(HCC)是一个全球性的疾病,每年新增病人数超过70万,死亡率居恶性肿瘤第二。甲胎蛋白(AFP)是HCC早期诊断中经典的标志物,由于其低灵敏度导致的假阴性问题较为普遍,因此临床上需要更有效的早诊标志物。但在新的标志物筛选中,常常面临着两个问题:①系统性、全局性不够;②精准度不够,即从海量的原始数据中无法精准定位某一个或某几个靶标分子。
为解决上述问题,复旦大学附属中山医院肝癌研究所高强团队基于HuProt™人类蛋白质组芯片系统性、全局性地筛选HCC早期诊断标志物,通过集成逻辑回归(logistics regression)、人工神经网络(Artificial Neural Network)算法建立了针对肝细胞癌的精准区分模型,模型中包含了CIAPIN1、EGFR、MAS1、SLC44A3、ASAH1、UBL7和ZNF428这7种蛋白质,最后通过独立样本对模型的泛化能力进行验证。该研究在《Journal of Hematology & Oncology》在线发表(IF=23.1)。

图4 权威期刊在线发表
1、研究思路
该研究从复旦大学附属中山医院、东方肝胆外科医院、广西医科大学附属肿瘤医院收集了肝癌、肝硬化和健康对照的1253份血清样本(肝癌,n=611;肝硬化,n=249;健康对照,n=393),并基于标志物研究的“经典三阶段”,分别为发现(Discovery Phase)、测试(Test Phase)、验证(Validation Phase)开展项目实验。
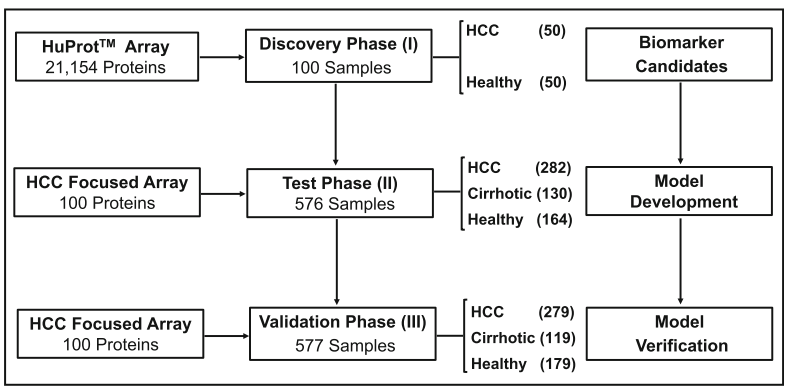
图5 实验设计流程
2、潜在自身抗体(AAb)标志物确定
在发现阶段,基于HuProt™人类蛋白质组芯片对50例肝细胞癌患者和50例健康人的血清样本进行检测,共筛选出81个肝细胞癌患者的特异性免疫高响应的自身抗体(AAb)(图6),其中候选蛋白的筛选标准:①P≤0.05;②Fold Change≥1.2;③阳性率≥10%( HCC阳性反应率定义为大于健康对照组的平均值加2×SD),并结合肝癌相关参考文献额外纳入19个感兴趣的AAb,共计100个潜在标志物进行后续验证。
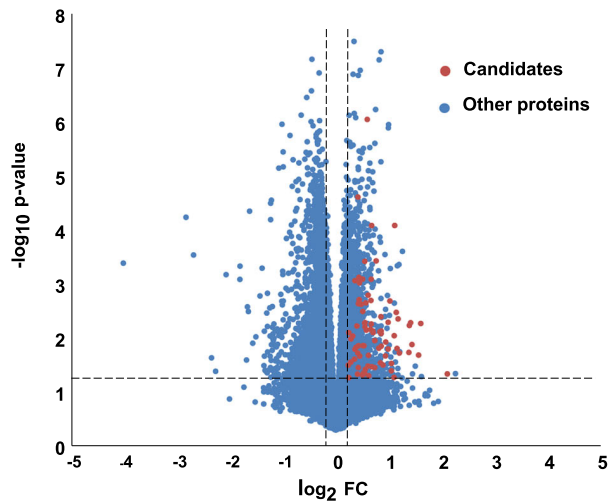
图6 HuProt™人类蛋白质组芯片筛选潜在标志物
3、7-AAb 联合panel建立
在测试阶段,将筛选出的100个潜在标志物,制备成肝癌特异的定制芯片,并扩大样本量(共计576例,其中肝癌n=282,肝硬化n=130,健康对照n=164)进行测试。

图7 HCC患者、肝硬化患者、健康对照样本的信号强度
基于定制芯片测试结果,分别比较分析HCC与Cirrhotic、HCC与healthy数据,并基于p-value <0.05,fold change≥1.2,sensitivity>15%,specificity>90%判定标准,筛选出55个潜在的生物标志物。
为更加精准筛选出具备显著区分能力的单个或多个标志物,基于逻辑回归(logistics regression)算法对55种潜在的生物标志物进行进一步筛选,并通过10-fold cross validation(图8A)筛选出7个蛋白,分别为CIAPIN1、EGFR、MAS1、SLC44A3、ASAH1、UBL7和ZNF428。
基于筛选出的标志物,通过神经网络中error BackPropagation算法建立多个人工神经网络(ANN)模型,并将模型进行集成,对肝细胞、肝癌患者和其他对照样本进行区分。在项目研究中建立的人工神经网络为全连接前馈神经网络,网络分为三层,输入层为7个神经元,隐含层为5个神经元,输出层为2个神经元(图8C)。其中,所建立的7-AAb panel的ANN模型的sensitivity=68.6%,specificity=92.1%,AUC=0.894(HCC VS对照[健康+肝硬化]),优于AFP(临界值=400mg/mL,sensitivity=28.4%,specificity=98.7%,AUC =0.808)。
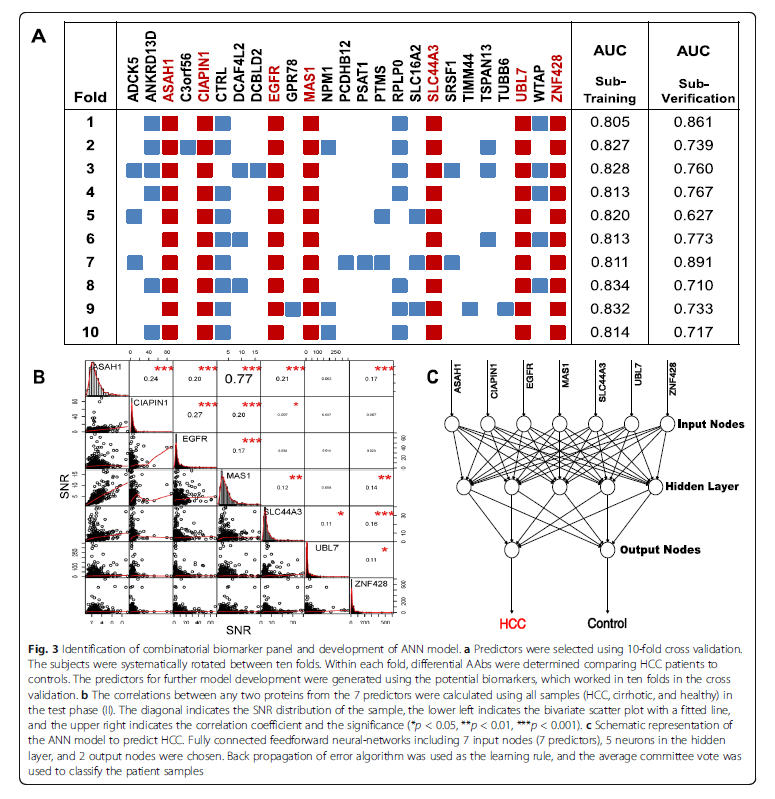
图8 基于人工神经网络的模型开发
4、7-AAb 联合panel的验证
在验证阶段,577例样本(279例肝细胞肝癌, 179例正常,119例肝硬化患者)作为独立样本,通过盲测法对模型进行验证。在盲测过程中,通过训练产生的模型委员对每例样本进行投票,确定是否为肝癌患者,再通过临床确诊信息来确定模型的准确度。

图9 ANN模型的工作流程
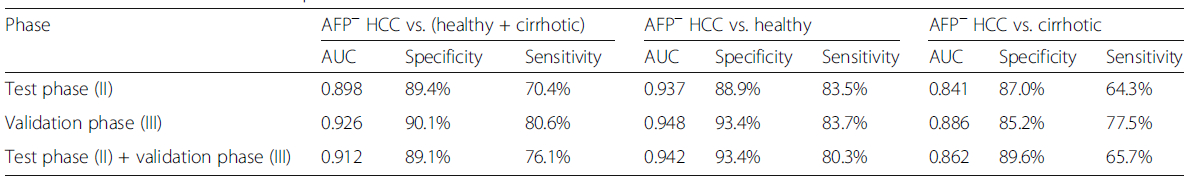
对于建立的ANN模型,通过独立样本验证其泛化能。验证结果中,sensitivity=68.6%,specificity= 90.1%,AUC=0.902(HCC VS对照[健康+肝硬化])(表1),并且对于AFP阴性患者,即AFP指标无法检出的患者,ANN模型的sensitivity=80.6%,specificity=90.1%,AUC=0.926(AFP-HCC VS对照[健康+肝硬化])(表2)。综合,ANN模型的灵敏度(62.2~77.5%)优于AFP(30.7%)。
当结合测试阶段和验证阶段的数据时,整体sensitivity=71.6%,specificity=90.0%,AUC=0.898(HCC VS对照组[健康+肝硬化])(表2),对于AFP阴性患者,整体sensitivity=76.1%,specificity =89.1%,AUC=0.912(AFP-HCC与对照组[健康+肝硬化])(表2)。
表1 在HCC检测中评估7-AAb panel和AFP
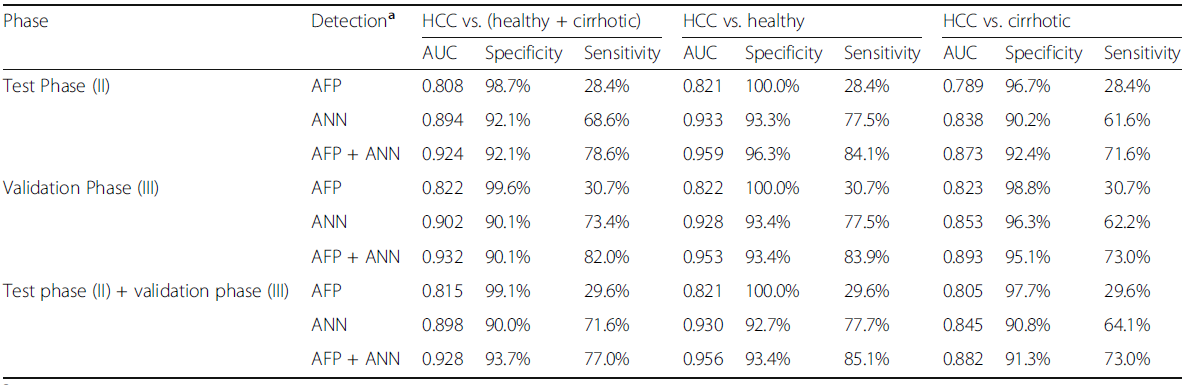
表2 在AFP-HCC检测中评估7-AAb panel
5、7-AAb 联合panel的应用
乙型肝炎表面抗原(HBsAg)可用于确定患者是近期还是长期感染HBV。实验中,大约70%的HCC患者为HBsAg+。对于HBsAg+-HCC检测,该模型提供了59.6~79.1%的灵敏度和85.2~95.5%的特异性(AUC =0.822~0.932),而AFP(临界值400mg/mL)提供了31.4~34.7%的灵敏度和96.7-100%的特异性。这说明ANN模型能够有效地检测出HBsAg--HCC患者。
综上所述,该项研究确定并验证了一个由7个自身抗体组成的肿瘤早期诊断模型,可有效检测肝癌,并且其检测效能是优于传统标志物AFP,尤其是AFP阴性患者。该项成果在肝癌的无创早期检测具有巨大的临床价值,并为了解肝癌发生的免疫反应提供了新的线索。
三、分析总结
目前,肿瘤相关自身抗体对于肿瘤患者早期诊断、病情监测、手术预后等方面的意义仍需深入探索。而HuProt™人类蛋白质组芯片和定制芯片的应用,能够为标志物的筛选提供系统性和全局性的解决方案。
参考文献
Zhang, S., Liu, Y., Chen, J. et al. Autoantibody signature in hepatocellular carcinoma using seromics. J Hematol Oncol 13, 85 (2020).
图片来源
参考文献与网络
下期预告:
除肿瘤之外,多种自身免疫性疾病(如红斑狼疮、克隆氏病、多发性硬化等),同样会在体内产生和累积大量的自身抗体。面对这类疾病,我们又该如何进行标志物筛查呢?
体必康生物科技(广东)股份有限公司
【业务咨询】
请联系:17727140658
微信:TBKjun
二维码:

如有需要,也可加入【体必康科研交流群】进行交流与学习
