体必康科研平台的药物小分子芯片,包含3375种小分子化合物(其中,1053种为中药单体、1527种为FDA批准的药物、795种为小分子抑制剂),可用于蛋白质、细胞裂解物、抗体、核糖核酸、活细胞等的配体化合物筛选,具有高通量、高灵敏度等特点,是靶向药物开发中的有力工具。

导语
药靶是疾病发展中起重要作用的生物大分子,可以通过外源分子与靶点的结合来治愈疾病。这些靶点包括激酶、受体和通道蛋白等。其中,激酶是“可成药”靶点代表,其特点是与疾病的进展密切相关;有明确定义的疏水口袋,可实现高亲和力和特异性配体结合,并且与配体结合后可改变靶蛋白的活性或功能。然而,这些可成药的靶点仅占整个人类蛋白质组的2%。大部分的靶蛋白与疾病进展有关,由于缺乏明确的配体结合口袋、蛋白晶体结构研究极少等特点,通过传统方法“难以成药”或“尚未成药”,因此被称为“不可成药靶点”。
小分子微阵列芯片(Small molecule microarray,SMM),是将不同小分子药物(或待筛选化合物)集成在固相载体上形成微阵列,也称为药物小分子芯片。该芯片包含3375种小分子化合物(其中,1053种为中药单体、1527种为FDA批准的药物、795种为小分子抑制剂),可用于“可成药靶点”、“不可成药靶点”的配体化合物筛选,是靶向药物开发中的有力工具。
01.研究背景
神经退行性疾病是一类大脑和脊髓的神经元细胞丧失所致的疾病状态,随着时间的推移而恶化,最终导致功能障碍。大多数神经退行性疾病是由特定的致病蛋白质积累引起,如突变HTT蛋白(mHTT)是导致亨廷顿病(HD)的主要原因。而这些致病靶点蛋白由于缺乏“活性口袋”,难以被直接抑制,因此这些蛋白被称为“不可成药”靶点。而如何通过小分子化合物特异性靶向这些“不可成药”靶点,是当前生物医药领域最重大的问题之一。
为解决上述问题,复旦大学生命科学学院鲁伯埙、丁澦课题组与信息科学与工程学院费义艳课题组另辟蹊径,提出通过筛选靶蛋白结合化合物,并针对这些化合物进行表型筛选,以发现“不可成药靶点”的“广义抑制剂”来干预疾病的思路。研究团队通过小分子芯片(SMM)等技术发现了21种潜在的亨廷顿病致病蛋白mHTT的选择性结合剂,并结合二级表型筛选等最终明确地奈德可以通过结合mHTT的N端区域来增强mHTT在K6位点的多泛素化,使其更多靶向泛素-蛋白酶体途径降解,为疾病新药研发提供了可能的新策略。相关研究成果已在期刊《PNAS》上发表(IF=12.8)。
02.研究思路

03.研究结果
3.1疾病相关靶点的互作小分子筛选
为识别与mHTT选择性相互作用的化合物,研究团队使用重组突变的HTT蛋白(mHTT)和野生型HTT蛋白(wtHTT)与小分子芯片(SMM)孵育,通过扫描GFP荧光信号检测与靶蛋白存在相互作用的药物小分子化合物,并以wtHTT为对照,鉴定出mHTT特异性结合小分子化合物共21个。

小分子芯片实验结果图
3.2互作小分子二级筛选
细胞功能验证筛选
研究团队对鉴定出的21个mHTT特异性结合小分子做了进一步功能筛选,发现HD模型(表达mHTT蛋白)STHdhQ7/Q111细胞会随着mHTT蛋白的积累,出现mHTT依赖性凋亡信号(caspase-3激活),而WT模型(表达wtHTT蛋白)使用蛋白酶抑制剂MG132经血清饥饿法诱导产生非mHTT依赖性凋亡信号。
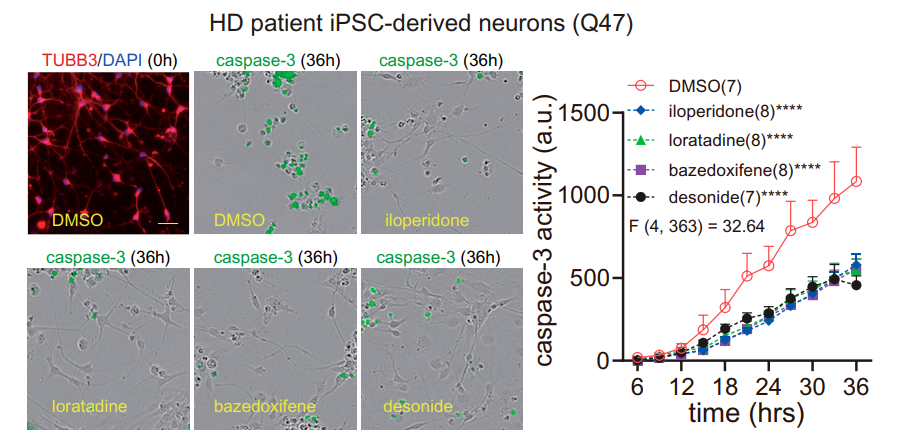
结果显示,21个mHTT特异性结合小分子中有5个小分子,分别是地奈德(desonide)、巴扎多昔芬(bazedoxifene)、氯雷他定(loratadine)、伊洛哌酮(iloperidone)和棉酚(gossypol)对细胞凋亡有显著抑制作用,其中棉酚(gossypol)在野生型(WT)纹状体细胞(STHdhQ7/Q7)中产生非特异性抑制凋亡作用。因此,研究团队分析前四种化合物可能通过与mHTT的相互作用,来特异性抑制mHTT引起的细胞毒性。该结果也在患者诱导的多能干细胞衍生神经细胞(Q47)得到了进一步验证。
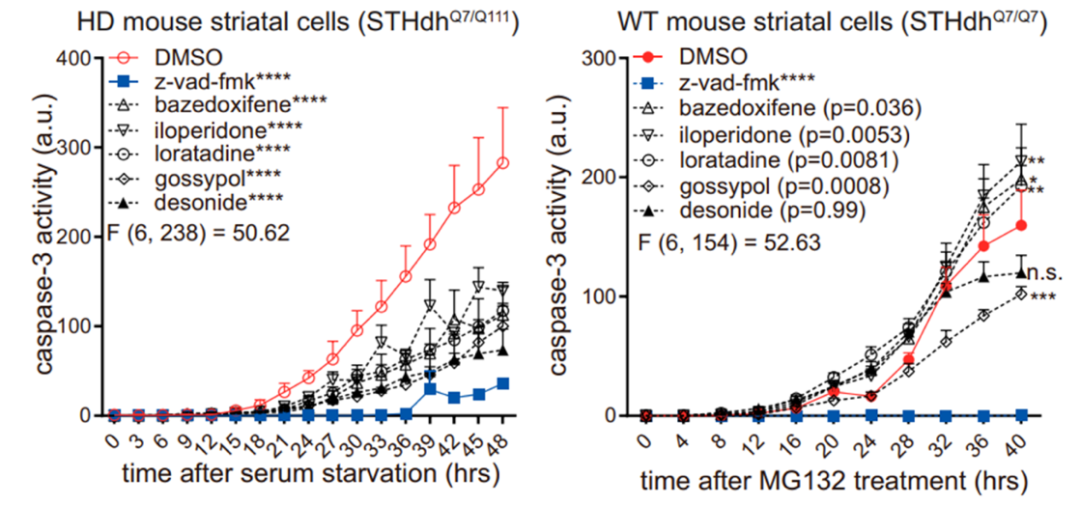
caspase-3活性分析小分子对HD模型(左)和野生型(右)细胞凋亡拯救效果
caspase-3活性分析小分子对来源于HD患者细胞的细胞凋亡拯救效果
分子结合验证筛选
研究团队同时在分子生物学层面证实了这些化合物的mHTT特异性结合。结果显示,4种化合物均不与wtHTT结合,仅与mHTT特异结合。
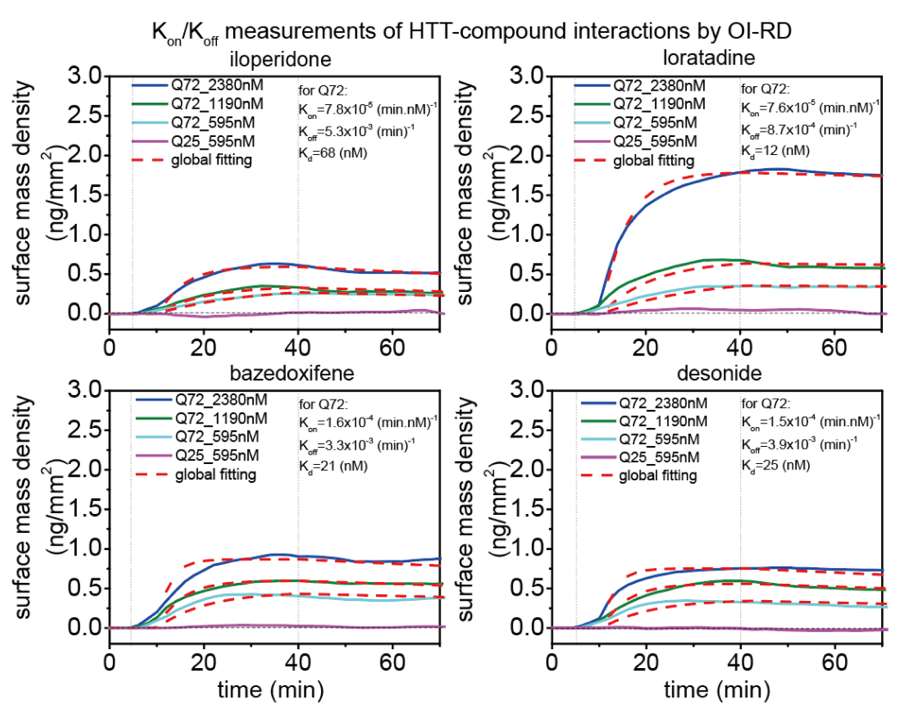
斜入射反射率差(OI-RD)测量了小分子与mHTT(Q72)和wtHTT(Q25)的亲和力
体内实验功能验证筛选
研究团队还基于HD小鼠模型对四种化合物的治疗效果进行了验证筛选。研究人员通过侧脑室内(icv)给药将四种化合物直接输送到小鼠大脑,以小鼠开放场和饲养行为作为潜在HD相关表型的判断依据。结果显示,伊洛哌酮(iloperidone)使小鼠活动性降低并无法继续应用于治疗,氯雷他定(loratadine)没有效果,巴扎多昔芬(bazedoxifene)有轻微的挽救作用,而地奈德(desonide)有效提高了HD小鼠活动范围且改善效果最明显。
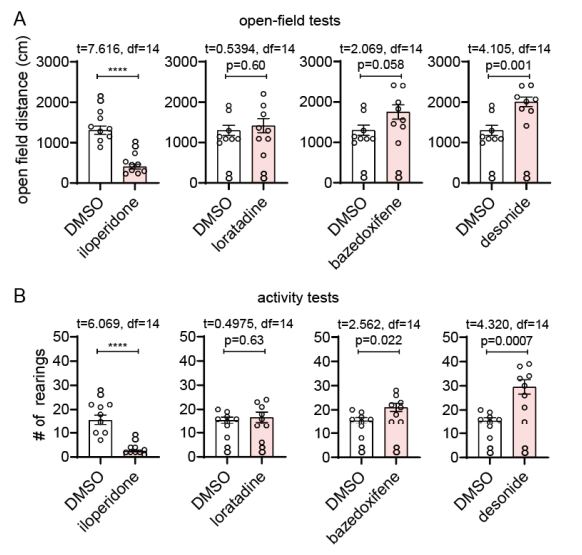
小鼠开放场(上)和饲养行为(下)分析小分子药物治疗HD效果
为进一步验证地奈德的治疗效果,研究团队使用地奈德治疗HD小鼠并与WT小鼠对照,对HD相关表型进行更全面的表征,包括开放场行为、握力、饲养频率、光束行走时间和旋转棒性能的测试。结果显示,经地奈德注射的HD小鼠在所有这些行为测定中表现出显著改善的运动性能,而对WT动物没有显示出任何影响,证实了地奈德特异性的治疗效果。
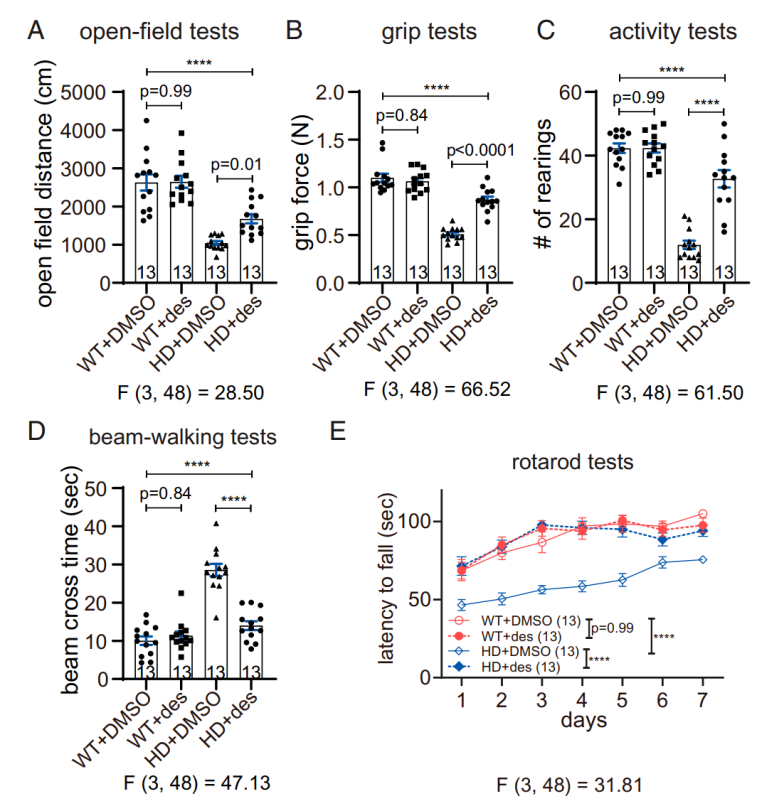
小鼠行为测试全面表征地奈德特异性治疗HD的效果
3.3验证化合物的疾病治疗效果
亨廷顿病(HD)主要由突变HTT蛋白(mHTT)累加引起,为进一步验证地奈德在体内分子水平上的作用,研究团队分析了HD的分子生物标志物,包括mHTT聚集体(S830),以及DARPP-32的水平。免疫荧光结果显示,地奈德显著降低了mHTT聚集,同时抑制了HD引起的DARPP-32下降。
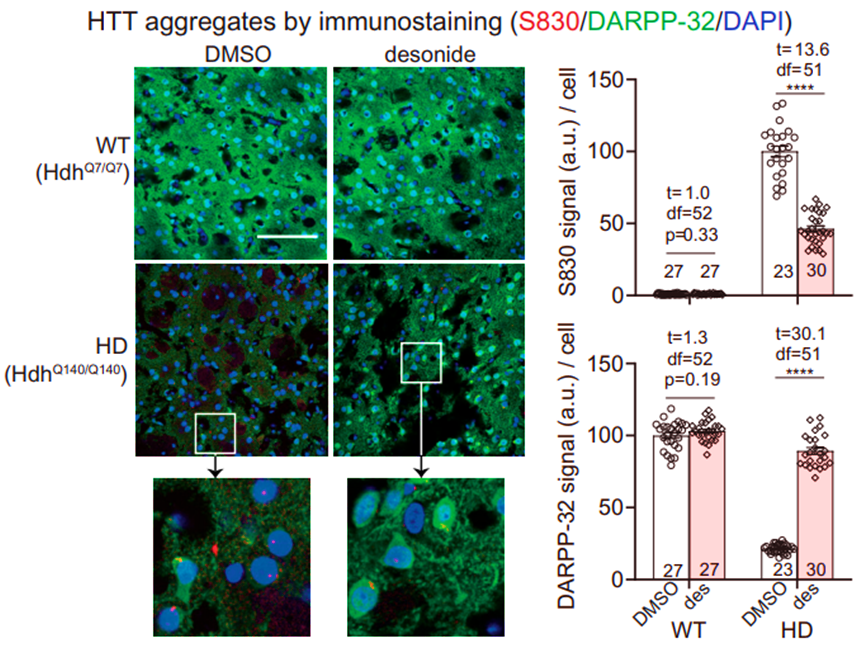
免疫荧光验证小鼠体内疾病相关标志蛋白的水平
3.4药物小分子作用机制研究
作用位点验证
mHTT片段主要由N端17个氨基酸(N17)、扩展的多聚谷氨酰胺(polyQ)片段和富含脯氨酸的结构域(PRD)组成。为进一步确定mHTT与地奈德的结合位点,研究团队通过微尺度热泳(MST)分析不同突变片段与地奈德的结合力。结果表明,缺乏PRD(ΔPRD)和N17中其他两个赖氨酸(K9和K15)或带负电荷的氨基酸谷氨酰胺(E12)的突变并没有消除结合,表明这些位点不是结合所必需的。N17的K6R突变消除了结合,即mHTT中的K6位点很可能是与mHTT相互作用所必需的位点。
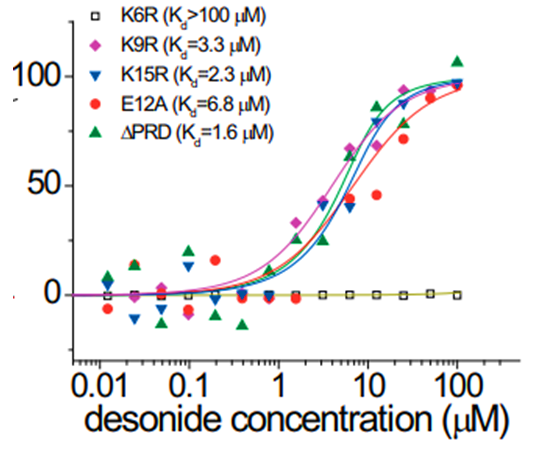
微尺度热泳(MST)分析不同突变片段与地奈德的结合力
作用功能验证
基于地奈德有效抑制mHTT引起的HD相关表型,研究团队继续探究其可能的作用机制。由于HD毒性的主要因素是mHTT蛋白积累,因此研究团队通过检测HD细胞内蛋白表达水平,证明了mHTT水平以地奈德剂量依赖性地显著降低,而wtHTT未受到显著影响,表明地奈德可以有效抑制mHTT蛋白积累。
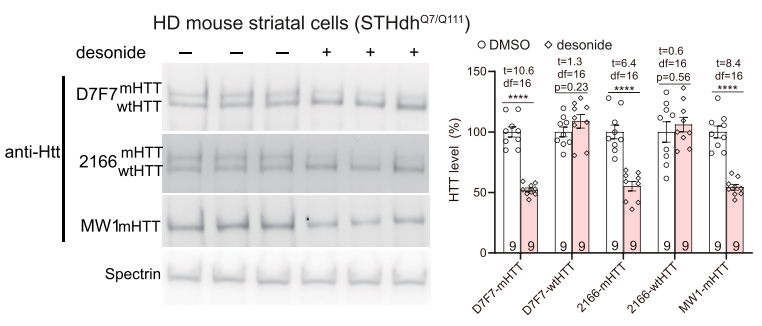
Western blot 验证地奈德处理对细胞内mHTT和wtHTT蛋白水平的影响
基于基因表达水平不变,mHTT蛋白量下降的原因可能是自噬引起蛋白内吞,也可能是蛋白酶引起的蛋白降解。研究团队使用蛋白酶体抑制剂MG132或自噬抑制剂氯喹(cholroquine)处理HD细胞(STHdhQ7/Q111),来模拟自噬和降解,以测试其对地奈德降低mHTT效果的影响。结果显示,蛋白酶体抑制剂MG132抑制蛋白降解后,地奈德作用效果消失,表明地奈德通过促进蛋白酶体降解,进而降低了mHTT积累。
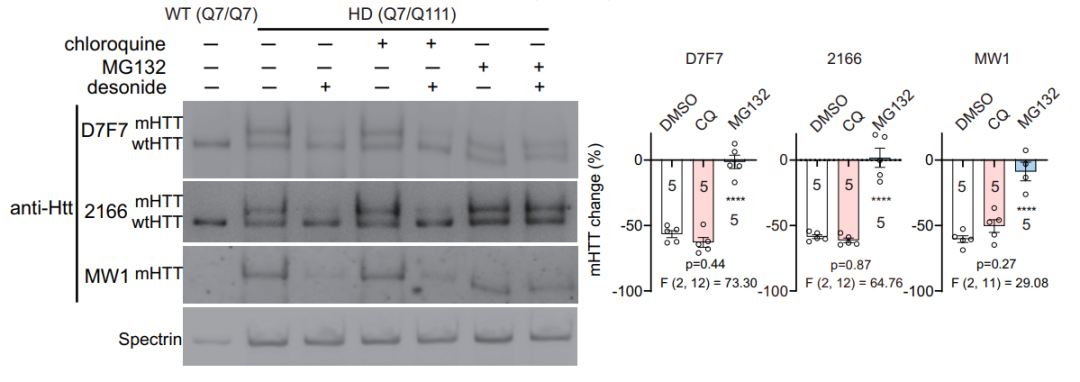
Western blot 验证蛋白酶或自噬对地奈德降低mHTT效果的影响
细胞内蛋白降解的主要途径是泛素-蛋白酶降解,而K6突变消除了地奈德-mHTT相互作用,因此研究人员推测,K6可能是介导地奈德效应的聚泛素位点。为验证推测,研究团队检测了不同位点突变的mHTT泛素化变化情况。结果表明,经地奈德处理后,蛋白泛素化水平升高,但K6位点突变使地奈德增强泛素化作用降低,在分子水平上证实了地奈德治疗HD时,依赖于mHTT蛋白K6位点,进而引起泛素化降解蛋白。
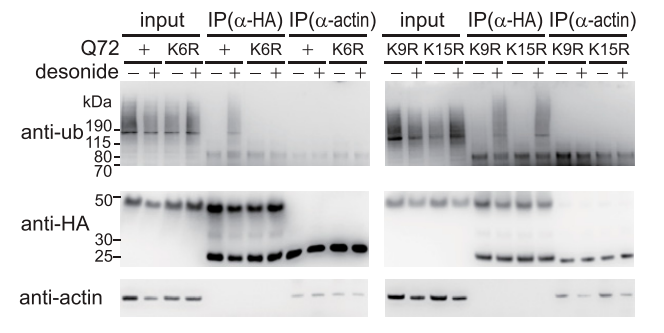
Western blot 验证地奈德引起mHTT K6位点泛素化
3.5药物小分子用药安全验证
地奈德(Desonide)是FDA批准的治疗特应性皮炎的药物,具有既定的外用安全性,以上结果也有力地证明了其在HD治疗中的潜力,但将其应用于临床治疗还需要调整至最佳的给药方式。为了验证外周给药的可能性,研究团队进行了初步的药代动力学研究,测试了通过外周注射给药地奈德对不同年龄的小鼠HD相关表型的潜在影响。结果显示,HD小鼠所有行为缺陷都通过4周注射给药得到了有效治疗,而WT小鼠没有受到影响,表明注射给药地奈德治疗HD是有效且特异的,这进一步证明了地奈德应用于临床治疗患者的可行性。
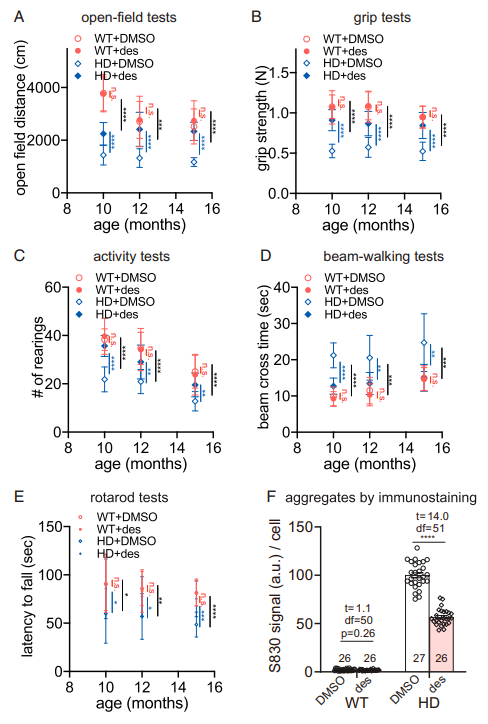
小鼠行为实验(A开放场测试、B握力测试、C活动力测试、D光束行走测试、E转棒测试)
和体内标志物S830检测验证注射给药的有效性
04.总结
经典的抑制剂可以通过直接结合靶蛋白的“活性口袋”改变其生化活性,而“广义抑制剂”则直接结合靶蛋白的某个区域而改变其对疾病表型的作用,绕过了对靶蛋白“活性口袋”以及“生化活性”的要求。本研究为针对“不可成药”靶蛋白大规模药物筛选提供了一种新的模式:首先筛选致病靶蛋白的直接结合化合物,然后根据化合物对疾病模型治疗效果进行表型筛选,并通过相应的表型和机制研究明确作用机理。
体必康集团依托中国科学院生物物理研究所搭建了科研平台,沉淀并转化了一系列蛋白质组学技术(从基因克隆、载体构建、蛋白表达,到芯片制备、样本检测及分析报告等一系列标准化、专业化、工业化的蛋白质芯片研发和服务技术),得到了行业的广泛认可。除此之外,体必康科研平台还提供其他组学技术服务,如质谱、测序等。
体必康科研以健康中国为己任,致力于“让临床科研不再难”,不仅提供单一的组学技术服务,还可以根据研究方向定制合适的动物研究模型,提供动物实验技术服务,并将分子细胞乃至动物实验等多项技术整合,为解决临床问题提供整体研究方案。与临床医生一起,从临床问题出发,系统全面地解析生命过程的发生、发展机制。
参考文献
Song H, Wang C, Zhu C, et al. Suppression of toxicity of the mutant huntingtin protein by its interacting compound, desonide. Proc Natl Acad Sci U S A. 2022;119(10)
图片来源
参考文献
下期预告
目前,关于靶向“不可成药靶点”的核心是利用细胞自身蛋白质降解的方法,来标记选定目标蛋白质并触发其降解的机制,例如PROTAC、ATTEC、LYTAC等靶向降解技术,其主流思路也是集中在设计或发现双功能降解剂的靶向降解技术。那么,在这类靶向降解技术的应用中,小分子芯片又是如何发挥作用的呢?